Publié le 20 mars 2020 – Mis à jour le 23 mars 2020
Un texte de la Minute Recherche par Philippe Arnaud (GReD, unité mixte de recherche Inserm / CNRS / Université Clermont Auvergne).
Notre ADN possède un répertoire de près de 20 000 gènes qu’il convient d’éteindre et d’allumer précisément en temps voulu afin d’assurer l’intégrité de l’organisme. Ainsi les gènes actifs (exprimés) dans les cellules de l’iris sont différents, et n’assurent donc pas la même fonction, que ceux exprimés dans le foie. Afin d’orchestrer cette partition, la cellule fait appel à un panel de modifications chimiques, dites épigénétiques, qui en se déposant sur les gènes forment des signaux qui distinguent ceux qui doivent être exprimés de ceux qui doivent rester éteints. Parmi ces modifications, la méthylation de l’ADN est la mieux caractérisée, son rôle essentiel dans le développement des mammifères n’étant plus à démontrer.
Sans surprise, cette partition est profondément altérée dans les cellules cancéreuses qui se caractérisent en effet par l’expression anarchique d’une partie de leurs gènes. La méthylation de l’ADN, dont la distribution le long de la molécule d’ADN est également largement perturbée dans les cellules cancéreuses, est communément considérée comme l’une des causes principales de cette altération. Ce postulat n’a pour autant jamais été vérifié de façon systématique.
Sur ce constat, nous avons utilisé le gliome, la forme la plus répandue des tumeurs cérébrales, pour établir la contribution exacte des altérations de méthylation aux défauts d’expression des gènes dans les cellules cancéreuses.
À contrepied de ce qui est communément admis, nos données relativisent l’importance de la méthylation sur l’expression anarchique observée dans les gliomes. C’est l’altération d’une autre marque, au nom scientifique de H3K27me3, qui émerge ici comme étant le défaut majeur des gènes dérégulés. Cette modification chimique, à la différence de la méthylation, ne cible pas l’ADN mais les protéines (histones) qui forment le nucléosome, structure autour de laquelle s’enroule l’ADN pour former la chromatine.
Nos résultats révèlent que la présence de H3K27me3 sur les gènes dans les cellules souches embryonnaires humaines, qui vont donner naissance à l’ensemble des cellules de l’organisme, prédispose ces gènes à être dérégulés dans les cellules cancéreuses. De plus, le niveau d’activité des gènes dans le cerveau sain va influencer le mécanisme par lequel ils seront éventuellement éteints dans le gliome. Les gènes fortement actifs sont en effet bien plus susceptibles d’être éteints par H3K27me3 que par la méthylation.
Cette étude, qui revisite le lien entre altérations épigénétiques et expression génique anarchique dans les cancers, nous incite à élargir notre vision dans le cadre de développement de médicaments visant à cibler les défauts épigénétiques dans les cancers.
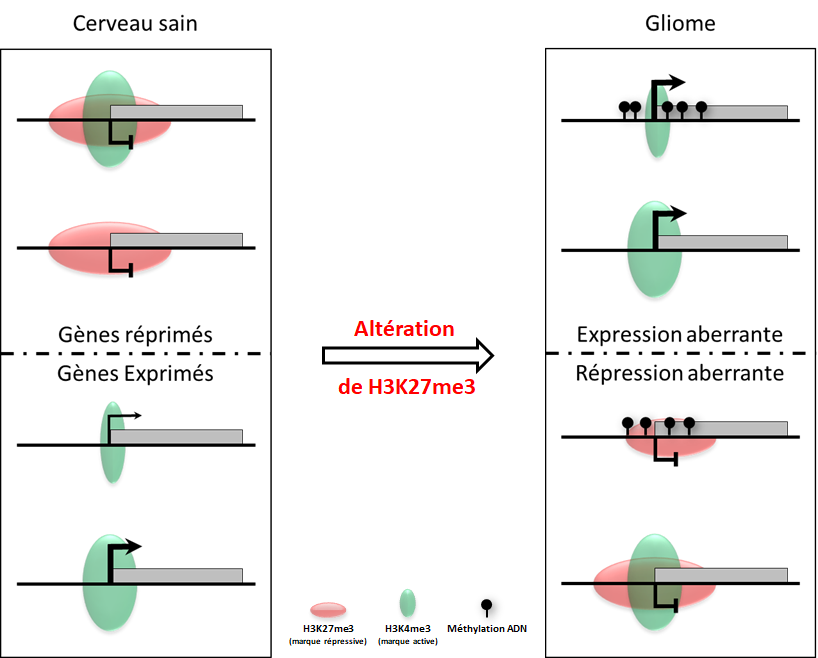
Légende illustration
Une distribution inappropriée de la marque H3K27me3 est la cause principale de l’activité anarchique des gènes dans les gliomes. Les gènes (rectangles gris) qui présentent un gain d’activité aberrant dans les gliomes (panel du haut) se caractérisent par une perte de la marque H3K27me3 (en rouge), à laquelle ils sont associés dans le cerveau sain, et un gain de la marque active H3K4me3 (en vert). De façon inattendue ce gain d’expression est associé à un gain de méthylation ADN pour un sous-groupe de gènes. A l’inverse les gènes qui s’éteignent dans le gliome (panel du bas) sont associés à un gain aberrant de H3K27me3. Seule une minorité, principalement ceux qui ont un niveau faible d’activité dans le cerveau sain, gagneront également de la méthylation ADN, qui est probablement subséquent au gain de H3K27me3.