Publié le 6 juin 2019 – Mis à jour le 7 juin 2019
Un texte de la Minute Recherche par Philippe Arnaud (GReD, unité mixte de recherche Inserm / CNRS / Université Clermont Auvergne) et Marc Berger (unité CHELTER).
La Leucémie Myeloide Chronique (LMC) est un cancer du sang et de la moelle osseuse. C’est l’un des rares cas de transformation maligne due à un seul évènement : une translocation entre les chromosomes 9 et 22 conduisant au rapprochement et à la fusion aberrante des gènes ABL et BCR. Il en résulte la production d’une protéine dite « chimère », BCR-ABL1 dans laquelle l’activité enzymatique « tyrosine kinase » de ABL1 est débridée, ce qui va conduire au développement de la LMC. De fait, des stratégies thérapeutiques basées sur l’utilisation d’inhibiteurs de tyrosine kinase (ITKs) ont fait leur preuve pour le traitement de cette pathologie.
Toutefois, plusieurs observations cliniques démontrent l’existence d’une sous-population de cellules résistantes aux ITKs. En particulier, les cellules souches leucémiques qui coexistent dans la moelle osseuse avec les cellules malignes plus différenciées, seraient capables de survivre malgré les traitements ITKs, et ainsi entrainer des rechutes.
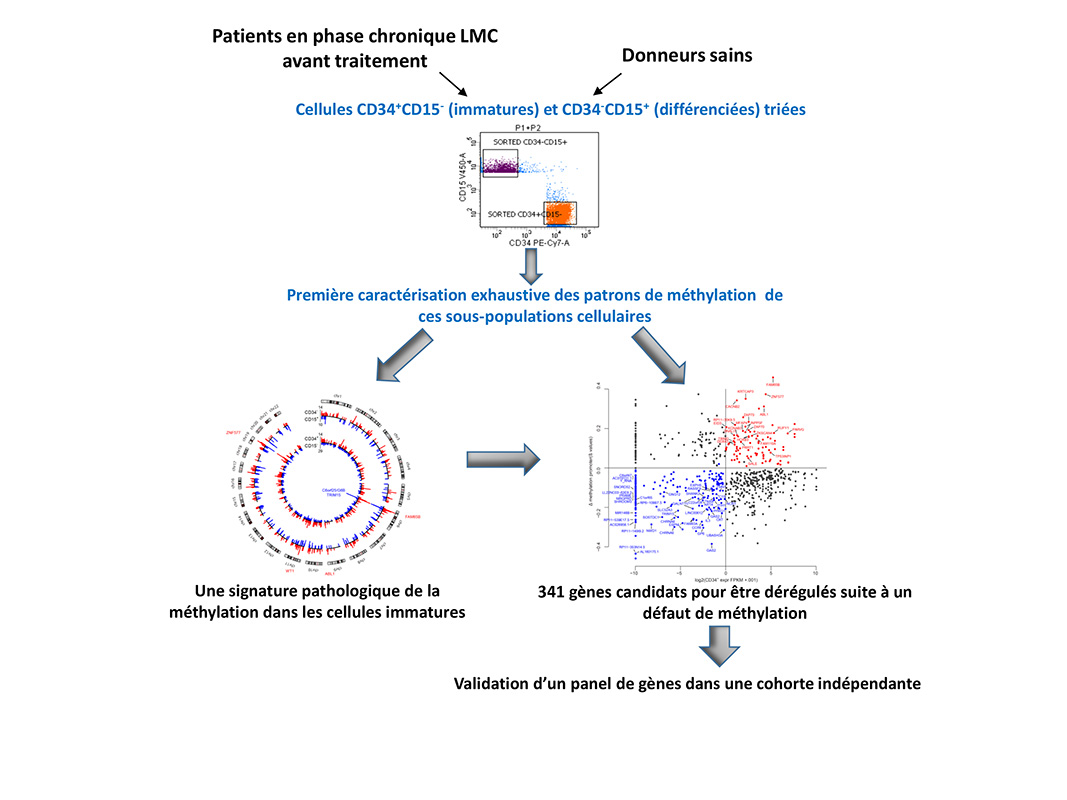
Parmi les mécanismes sous-jacents possibles, la méthylation, qui est une modification chimique se portant directement sur la molécule d’ADN, émerge, de par ses caractéristiques, comme un candidat pertinent. Le développement normal repose en effet sur le dépôt contrôlé de cette modification sur un ensemble de régions régulatrices. De fait une altération dans ce processus entraine des défauts dans le programme d’expression des gènes et conduit à des pathologies. Pour autant, et alors qu’une telle perturbation des patrons de méthylation est décrite dans de nombreux cancers, cette modification épigénétique reste largement sous-étudiée dans la LMC. Sur ce constat, les auteurs ont réalisé la première étude exhaustive du patron de méthylation lors des phases précoces de la LMC et ce avant traitement.
Suite à un tri cellulaire rigoureux, deux populations cellulaires ont été isolées sur les mêmes patients lors de la phase chronique de la maladie : une de cellules immatures, enrichie en cellules souches leucémiques, et une composée de cellule différenciées, et le patron de méthylation établi pour chacune de ces populations. Cette approche a permis de révéler une signature « pathologique » de la méthylation spécifique des cellules immatures et d’identifier plus de 300 gènes candidats, dont un panel a été validé, pour avoir une expression altérée suite à un défaut de méthylation.
Cette étude est la première à mettre en évidence l’implication de la méthylation de l’ADN dans l’hétérogénéité intra-clonale lors de la phase chronique de la maladie. De plus, elle fournit une ressource unique, ouvrant de nouvelles perspectives pour déterminer les bases moléculaires de la résistance au traitement.
Autres laboratoires partenaires
- Hématologie Biologique, CHU Clermont-Ferrand, Hôpital Estaing, Clermont-Ferrand Cedex 1, France.
- Equipe d'Accueil 7453 CHELTER, Université Clermont Auvergne, CHU Clermont-Ferrand, Hôpital Estaing, Clermont-Ferrand Cedex 1, France.
- Hématologie Clinique, CHRU Nancy, Hôpitaux de Brabois, Vandoeuvre-lès-Nancy, France.
- Hématologie Clinique, CH Annecy-Genevois, Epagny Metz-Tessy, France.
- Institut d'Hématologie de Basse Normandie, CHU de Caen, Caen Cedex 9, France.
- Hématologie Clinique, Institut Bergonié, Bordeaux Cedex, France.
- Centre Hospitalier de Versailles, service d'Hématologie et d'Oncologie, Le Chesney, France.
- Département d'Hématologie, Institut de Cancérologie Lucien Neuwirth, Saint-Priest-en-Jarez, France.
- CRB-Auvergne, CHU Clermont-Ferrand, Hôpital Estaing, Clermont-Ferrand Cedex 1, France.


